Pablo Tamiozzo1*, Pablo Camacho1
1- Departamento de Patología Animal- Facultad de Agronomía y Veterinaria- Universidad Nacional de Río Cuarto. Ruta 36 km 601, Río Cuarto, Cordoba, Argentina CP 5800. Tel (0358) 4676215. * e-mail: [email protected]
Introducción
La Neumonía enzoótica porcina (NEP) es una enfermedad respiratoria crónica de los cerdos, causada por Mycoplasma hyopneumoniae (M. hyopneumoniae). Esta enfermedad se caracteriza por una alta morbilidad, que puede llegar al 100% de los cerdos enfermos, pero con baja o nula mortalidad en caso de no existir infecciones secundarias causadas por bacterias (Thacker & Minion, 2012)
Cerdos de todas las edades son susceptibles a la infección por M. hyopneumoniae, sin embargo, la enfermedad usualmente no se presenta en animales menores de 6 semanas de edad. La NEP presenta una prevalencia particularmente alta en animales de desarrollo y terminación y la severidad de la misma depende de diversos factores como por ejemplo la presión de infección, la presencia de infecciones secundarias concomitantes y las condiciones ambientales (Thacker & Minion, 2012)
Diferentes estudios realizados en los últimos diez años han propuesto y demostrado interesantes aplicaciones de distintas técnicas y metodologías diagnósticas para la identificación de infecciones causadas por M. hyopneumoniae. Por ello el objetivo de la presente revisión es presentar los aspectos más destacados y novedosos al respecto.
El diagnóstico de rutina de la infección por M. hyopneumoniae se realiza por inspección de lesiones pulmonares en frigorífico, serología, específicamente ELISA y PCR.
En cuanto a las lesiones pulmonares, las lesiones compatibles con NEP son consolidaciones de color gris-violáceo localizadas bilateralmente en los lóbulos apicales, intermedios, accesorio y parte craneal de los lóbulos diafragmáticos (Maes et al., 2008). La observación y palpación de lesiones pulmonares en frigorífico es muy útil para estimar la prevalencia y la severidad de la NEP. Esta metodología, se torna especialmente importante ante la enfermedad subclínica, en donde existen lesiones pulmonares sin signología clínica o en casos incipientes debido a infecciones recientes. Sin embargo no provee información acerca del curso de la enfermedad ya que en infecciones de animales jóvenes, es probable que las lesiones pulmonares se resuelvan cuando éstos lleguen a edad de faena. Las lesiones pulmonares no solo impactan en la salud de los cerdos sino que también afectan negativamente la ganancia diaria de peso. En este sentido ha sido postulado que por cada 10% de pulmón afectado hay una pérdida en la ganancia diaria de peso de 37,4 grs (Straw, 1989), aunque esto es difícil de estimar con exactitud y existen en la literatura resultados controvertidos.
Independientemente del tamaño de la piara, la observación de lesiones pulmonares en frigorífico de 30 cerdos sería suficiente para evaluar la prevalencia y el impacto de la NEP, cuantificado por medio de la extensión de la lesión pulmonar (Morrison et al., 1985). Respecto a la prevalencia de lesiones pulmonares no existe demasiada controversia, dado que la proporción de pulmones afectados es fácil de calcular. En cuanto a la estimación de la extensión de la lesión, existen en la literatura distintas escalas que valoran de manera diferente a cada uno de los lóbulos pulmonares para estimar el área pulmonar afectada total (Goodwin et al., 1969; Hannan et al., 1982; Morrison et al., 1985; Straw et al., 1986; Christensen et al., 1999; Pfiffer & Brito 1990; Sibila et al., 2014) y así poder inferir el impacto en la ganancia diaria de peso
Independientemente de la escala utilizada, un estudio reciente (García Morante et al., 2016) demostró una buena correlación entre ocho escalas para la cuantificación de las lesiones pulmonares causadas por M. hyopneumoniae, por lo que para una aproximación al diagnóstico de la NEP cualquiera de las mismas es útil.
Un aspecto muy importante para mencionar aquí, es la evidencia del fuerte impacto de la diversidad genética del agente en la severidad de las lesiones pulmonares. Un estudio muy reciente ha demostrado que en cerdos provenientes de granjas donde circulaban más de siete tipologías genéticas distintas del agente, las lesiones compatibles con NEP fueron mucho más severas respecto de aquellos cerdos provenientes de granjas con una sola tipología del patógeno (Michiels et al., 2017). En este sentido, nosotros hemos obtenido resultados similares en un trabajo realizado en granjas de nuestro país, evaluando lesiones pulmonares microscópicas, en donde se observó 3,5 veces más lesiones pulmonares compatibles con NEP en aquellas granjas con más diversidad genética del patógeno (Datos inéditos).
La serología, específicamente el ELISA es la prueba serológica más utilizada para la realización de perfiles de anticuerpos en ensayos transversales o longitudinales para determinar la presencia de anticuerpos maternos y la seroconversión que puede deberse a la infección natural o la vacunación. No nos es ajeno, sino más bien una práctica muy utilizada, que en base a un seroperfil se determine en cada granja el momento de la vacunación y/o la instauración de un pulso de antibióticos, sin embargo la técnica presenta ventajas y desventajas.
La técnica de ELISA es una prueba rápida, barata y fácil de realizar. Existen varios formatos de ELISA comerciales que difieren en la sensibilidad y especificidad, pero que brindan información igualmente valiosa en el monitoreo de anticuerpos contra M. hyopneumoniae.
Las diferencias obtenidas en los seroperfiles pueden variar de acuerdo a la técnica comercial utilizada. La incapacidad de diferenciar entre anticuerpos vacunales de aquellos producidos por una infección natural, la falta de correlación entre los niveles de títulos de anticuerpos y la protección que confieren, la variación entre la detección de anticuerpos que generan las diferentes cepas (alta y baja virulencia) del agente y la variabilidad individual en la capacidad de seroconversión, hacen que la interpretación de los resultados serológicos deban interpretarse cautelosamente. La seroconversion en condiciones de campo puede variar entre 3 a 9 semanas post-infección (Andreasen et al., 2000; León et al., 2001).
Debido a las dificultades en el cultivo del microorganismo, la reacción en cadena de la polimerasa (PCR) constituye una poderosa herramienta para la detección directa rápida del agente a partir de muestras clínicas. Puesto que el agente coloniza el epitelio del tracto respiratorio bajo, las muestras más adecuadas para determinar la presencia del agente son los hisopados traqueo-bronquiales o lavados bronquio-alveolares. Debido a la eliminación intermitente del agente, el hisopado nasal es una muestra clínica que representativa de la infección a nivel poblacional, pero no es muy útil para determinar el estado sanitario a nivel individual (Otagiri et al., 2005).
A partir de hisopados nasales pueden realizarse perfiles de PCR para determinar la dinámica de la infección y determinar la edad de los animales en los que existe mayor diseminación. Con el advenimiento de las reacciones de PCR de segunda generación, más específicamente la PCR en tiempo real, es posible la cuantificación del microorganismo en la muestra clínica para así poder determinar la cantidad de microorganismo presente en la muestra.
En cuanto a la signología clínica, pueden darse dos formas de la enfermedad: la forma epidémica y la forma endémica. La forma epidémica o epizoótica es poco frecuente y se presenta cuando el agente ingresa a una población de animales susceptibles sin contacto previo y por ende sin inmunidad, contra el agente. En este caso la enfermedad se dispersa rápidamente en animales de cualquier edad y los cerdos infectados eliminan altas cargas de microorganismo en los aerosoles durante los accesos de tos. Puede presentarse tos no productiva, fiebre o incluso la muerte. Lamentablemente para aquellos que esperan encontrar estas manifestaciones clínicas espectaculares, esta forma tan evidente de la enfermedad es poco usual debido a la alta prevalencia de la misma.
La forma endémica o enzoótica es la más frecuente y representa el verdadero desafío para los colegas de campo, puesto que debido al curso subclínico de la misma requiere de una avezada observación para el arribo a un diagnóstico de certeza, siempre acompañado por técnicas diagnósticas de laboratorio. En este caso y dependiendo del manejo sanitario de cada granja en particular, puede impactar en animales de distintas edades. En este escenario podemos visualizarla solamente en la alteración de los índices productivos previamente mencionados, puede haber tos seca, no productiva en cerdos de recría, desarrollo o terminación. Debido que en estos casos existe una inmunidad poblacional contra el agente, la diseminación de la enfermedad es lenta e insidiosa y puede existir un escaso número de animales con sintomatología clínica o ninguno, comportándose subclínicamente.
Si bien la tos seca no es un signo distintivo de la NEP, puesto que otros agentes pueden causar el mimo tipo de tos, un estudio reciente demostró su valoración en animales en terminación, concluyendo que cuando el índice de eventos de tos es mayor a 2,5 y existe una prevalencia por serología, más específicamente ELISA, mayor al 50% en estos animales, es muy probable que la tos sea causada por M. hyopneumoniae (Nathues et al., 2012). Para calcular el índice de tos o la proporción de animales afectados, es necesario exacerbar la sintomatología clínica moviendo a los animales. Si bien existen varios protocolos para la medición de estas tasas, un protocolo útil y fácil consiste en entrar a las salas o galpones tranquilamente, luego movilizar los cerdos por 30 segundos, contabilizar los cerdos con tos durante tres minutos; Esperar un minuto; Repetir la movilización y el conteo por tres minutos y después calcular el promedio de la proporción de cerdos con el síntoma sobre el total de animales por galpón o corral. A modo de conclusión, la cuantificación de la tos es una herramienta diagnóstica poco costosa, que puede brindar información importante acerca del comportamiento e impacto de la enfermedad y que puede ser realizada por personal de la granja. Nuestro grupo de trabajo ha estandarizado protocolos para la medición de tos en animales de diferentes edades lo cual ofrecería información valiosa cuando se combina con otras técnicas diagnósticas (Camacho, 2016).
El caso
Ahora bien, para demostrar la utilidad de la combinación de distintas técnicas para el diagnóstico de una infección por M. hyopneumoniae y antes de llegar al quid de la presente revisión, queremos mostrar resultados previamente publicados (Camacho et al., 2014). Para el monitoreo del citado estudio se realizó un estudio transversal en animales de diferentes edades provenientes de una piara parto-terminación, sin vacunación contra M. hyopneumoniae, después de un brote de NEP. Si bien es un caso peculiar, ilustra de manera perfecta la performance de las técnicas mencionadas y nos permitirá arribar al núcleo de esta revisión.
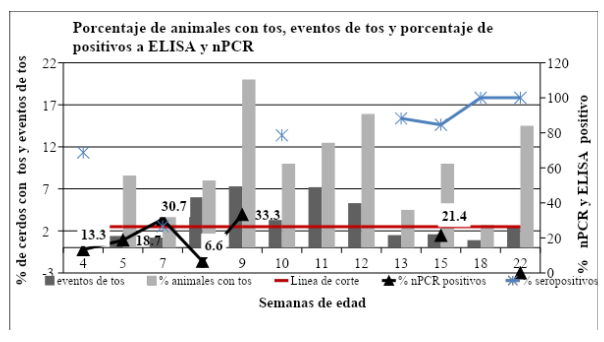
Como se dijo, se realizó un estudio transversal en donde se midió la proporción de animales con tos y se calculó el índice de tos (eventos de tos) en animales de diferentes edades de acuerdo al protocolo propuesto por Nathues et al. (2012) para animales de terminación. Así, la clinimetría se midió en cerdos de 4, 5, 7, 8, 9, 10, 11, 12, 13, 15, 18 y 22 semanas de edad según el protocolo descripto previamente. Además se tomaron muestras de hisopado nasal para PCR (Calsamiglia et al., 1999) en animales de 4, 5, 7, 8, 9, 15 y 22 semanas de edad y muestras de sangre para la detección de anticuerpos por ELISA (HerdCheck M. hyopneumoniae Ab ELISA test kit, Idexx) en animales de 4, 7, 10, 13, 15, 18 y 22 semanas de edad. La figua 1 muestra los eventos de tos y el porcentaje de animales con tos según cada edad. La línea roja (2,5) determina el umbral de eventos de tos, sobre el cual, en granjas que presentan más del 50% de positivos por serología a M. hyopneumoniae en animales de terminación, es altamente probable que la tos sea causada por M. hyopneumoniae (Nathues et al., 2012) pudiendo incluso reemplazarse el diagnóstico por PCR. Se muestra que en los muestreos entre las 8 y las 12 semanas de edad, lo eventos de tos fueron mayores al valor del umbral (2,5), alcanzando picos a las 9 y a las 11 semanas de edad. Respecto al porcentaje de animales afectados, los valores máximos con 20%, 16% y 15% se observaron a las semanas 9, 12 y 22 respectivamente. Esto permite inferir que en los muestreos de las 9 y 12 semanas, el impacto del evento tos es mayor viéndose afectados una gran proporción de animales respecto a los muestreos de las otras semanas. A las 22 semanas, si bien el porcentaje de animales afectados as alto, el índice de tos se encuentra justo en el umbral.
También puede observarse como la PCR fue capaz de detectar a las 4 semanas la presencia del agente, con un porcentaje mayor al 10% (13,3% específicamente), alcanzando el pico máximo a las 9 semanas (33,3%), coincidiendo con el pico de eventos de tos y proporción de animales con tos. Se observa también que la seroconversión se presenta entre las 7 y las 10 semanas de edad, 3 semanas después de la detección por PCR y una semana antes de que el evento de tos sobrepase el umbral a la semana 8.
Figura 1. Perfiles clinimétrico (porcentaje de tos y eventos de tos), serológico y de PCR realizado en animales de diferentes edades.
Después de realizar el citado monitoreo, se implementaron en la piara medidas de control contra la enfermedad, más específicamente vacunación contra M. hyopneumoniae en las madres y tratamiento antibiótico estratégico en la ración de tiamulina y clortetraciclina en un pulso de 15 días a la edad a las 6 semanas de edad.
Después de la implementación de las medidas de control, se realizó un nuevo monitoreo clinimétrico en animales de 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20 y 22 semanas de edad y monitoreo de PCR en cerdos de 4, 5, 6, 7, 8, 9, 14, y 18 semanas de edad. En esta ocasión no se realizó un seroperfil (ELISA).
Como puede observarse en la figura 2, la proporción de animales con tos y el valor de eventos de tos se desplazaron hacia las 16 y 22 semanas de edad. El valor de eventos de tos, solo alcanzo el valor del umbral (2,5) a las 22 semanas de edad. No hubo PCR positivos hasta las 7 semanas de edad y hubo un 20% de PCR positivos a las 7, 8 y 16 semanas de edad.
Figura 2. Perfiles clinimétrico (porcentaje de tos y eventos de tos) y de PCR realizado en animales de diferentes edades
Discusión y conclusiones
Reconociendo las limitaciones de cada técnica o metodología diagnóstica utilizada se puede afirmar, al comparar ambos monitoreos realizados, antes y después de la implementación de medidas de control contra la NEP, que la misma logró controlarse de una manera efectiva, sin el uso excesivo de tratamiento antibiótico. Esto último es muy importante de recalcar dado los serios problemas de resistencia a los antimicrobianos.
Si bien el escenario anterior muestra una situación peculiar y seguramente muy poco frecuente, sirve para ilustrar la metodología utilizada. En este sentido hay varios aspectos que rescatar. En primer lugar, que la PCR no tiene un valor preclínico en granjas con infecciones endémicas (Sibila et al., 2007), sin embargo la prevalencia al destete por PCR es un indicador que permite predecir la severidad de la infección, ya que si es mayor al 10% seguramente la severidad de la NEP será mayor (Fano et al., 2007), que la seroconversion no es siempre tan evidente (León et al., 2001) y que el índice de tos no es fácilmente extrapolable a otras edades distintas, ya que los autores demostraron su asociación con la presencia de NEP solamente en animales en terminación (Nathues et al., 2012).
Si bien lo óptimo sería combinar las tres estrategias diagnósticas utilizadas, serología, PCR y monitoreo clínico, en forma de perfiles dado que brinda una información más detallada de la dinámica de la infección de M. hyopneumoniae dentro de la piara y permite una identificación más exacta del momento en el cual debería implementarse alguna medida de control, algo menos costoso podría realizarse considerando los aportes de cada técnica del siguiente modo:
1) PCR al destete: Determinar la prevalencia de PCR al destete, permitiría predecir el comportamiento de la enfermedad y la severidad de la misma si no se implementa alguna medida de control (Fano et al., 2007). Aparentemente con una prevalencia menor al 10% no habría de que preocuparse, mientras que si es mayor al 10% seguramente alguna medida de control debería ser implementada. Esto se visualiza en los monitoreos mostrados en el presente trabajo, en donde en el primero de ello la prevalencia fue de 13,3% y la severidad de la enfermedad, medida a través de parámetros clínicos, fue alta. Sin embargo en el segundo monitoreo, no hubo PCR positivos al destete y la severidad de la NEP fue menor.
2) Serología y clinimetría en cerdos de terminación: Como se dijo anteriormente, ha sido demostrado que si la prevalencia serológica es mayor al 50% y los eventos de tos superan el umbral de 2,5 en cerdos de la etapa de terminación, seguramente la NEP está presente en la piara representando un problema (Nathues et al., 2012). En estos casos, la medición de los parámetros clínicos podría suplantar el uso de la PCR.
3) Inspección de lesiones pulmonares en frigorífico: La inspección de lesiones pulmonares en frigorífico es una herramienta diagnostica muy utilizada. Independientemente de la escala utilizada para la cuantificación de las lesiones, aparentemente cualquiera de ellas permite una aproximación al impacto de la NEP en la piara (Gracia Morante et al., 2016). A pesar de ello, vale la pena resaltar que para la confirmación de una infección por M. hyopneumoniae, las pruebas de laboratorio son absolutamente necesarias.
A modo de conclusión, para el éxito de cualquier programa de control contra la NEP, el uso combinado de las herramientas diagnósticas hace que el programa sea más efectivo, ya que se puede determinar de modo más preciso el momento de mayor impacto de la enfermedad y a partir de allí planificar medidas para disminuir dicho impacto en la piara.
Referencias bibliográficas
Andreasen M, Nielsen JP, Baekbo P, Willeberg P, Bøtner A. A longitudinal study of serological patterns of respiratory infections in nine infected Danish swine herds. Prev Vet Med. 2000; 45(3-4):221-35.
Calsamiglia M, Pijoan C,Trigo A. Applications of a nested- polymerase chain reaction assay to detect Mycoplasma hyopneumoniae from nasal swabs. J Vet Diagnost Inv. 1999. 1: 246-251.
Camacho P, Tamiozzo P, Parada J, Carranza A, Busso JJ, Di Cola G, Ambrogi R, Ambrogi A. Dynamic of M. hyopneumoniae infection by clinimetry, PCR and ELISA. Proceeding of 23rd International Pig Veterinary Society (IPVS) Congress. June 8 – 11, 2014. Cancun, Quintana Roo, Mexico. P.491. 474
Camacho P. Desarrollo de un protocolo clinimétrico para el registro de estornudo en cerdos de recría. Tesis para optar al grado de Magister en Salud y Producción Porcina. Facultad de Agronomía y Veterinaria. Universidad Nacional de Río Cuarto. Mayo 2016.
Christensen G, Sorensen V, Mousing J. Diseases of the respiratory system. In: B Straw, S D’Allaire, W Mengeling, DJ Taylor, Eds. 1999. Diseases of Swine, 8th ed. Iowa State University Press, Ames. 1999: 913-940.
Fano E, Pijoan C, Dee S, Deen, J. Effect of Mycoplasma hyopneumoniae colonization at weaning on disease severity in growing pigs. Can J Vet Res. 2007; 71: 195-200.
Garcia-Morante B, Segalés J, Fraile L, Pérez de Rozas A, Maiti H, Coll T, Sibila M. Assessment of Mycoplasma hyopneumoniae-induced Pneumonia using Different Lung Lesion Scoring Systems: a Comparative Review. J Comp Pathol. 2016;154 (2-3):125-34.
Goodwin RF, Hodgson RG, Whittlestone P, Woodhams RL. Some experiments relating to artificial immunity in enzootic pneumonia of pigs. J o Hyg. 1969; 67, 465- 476.
Hannan PC, Bhogal BS, Fish JP. Tylosin tartrate and tiamutilin effects on experimental piglet pneumonia induced with pneumonic pig lung homogenate containing mycoplasmas, bacteria and viruses. Res Vet Sci. 1982; 33, 76-88.
León E, Madec F, Taylor N, Kobisch M. Seroepidemiology of Mycoplasma hyopneumoniae in pigs from farrow-to-finish farms. Vet Microbiol. 2001. 78(4):331-41.
Maes D, Segales J, Meyns T, Sibila M, Pieters M, Haesebrouck F. Control of Mycoplasma hyopneumoniae infections in pigs. Vet Microbiol. 2008;126 (4):297-309.
Michiels A, Vranckx K, Piepers S, Del Pozo Sacristán R, Arsenakis I, Boyen F, Haesebrouck F, Maes D. Impact of diversity of Mycoplasma hyopneumoniae strains on lung lesions in slaughter pigs. Vet Res. 2017;48(1): 2.
Morrison RB, Hilley HD, Leman AD. Comparison of methods for assessing the prevalence and extent of pneumonia in market weight Swine. Can Vet J. 1985; 26, 381-384.
Nathues H, Spergser J, Rosengarten R, Kreienbrock L, Grosse Beilage E. Value of the clinical examination in diagnosing enzootic pneumonia in fattening pigs. Vet J. 2012; 193(2):443-7.
Otagiri Y1, Asai T, Okada M, Uto T, Yazawa S, Hirai H, Shibata I, Sato S. Detection of Mycoplasma hyopneumoniae in lung and nasal swab samples from pigs by nested PCR and culture methods. J Vet Med Sci. 2005;67(8):801-5.
Piffer I & Brito J. Descrição de um modelo para avaliação e quantificação de lesões pulmonares de suínos e formulação de um índice para classificação de rebanhos. 1991. Documento 23. Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA). Ministério de Agricultura e Reforma Agrária. Centro Nacional de Pesquisa de Suínos e Aves (CNPSA). Concórdia, SC, Brasil.
Sibila M, Aragon V, Fraile L, Segales J. Comparison of four lung scoring systems for the assessment of the pathological outcomes derived from Actinobacillus pleuropneumoniae experimental infections. BMC Vet Res. 2014;10, 165.
Straw BE, Tuovinen VK, Bigras-Poulin M. Estimation of the cost of pneumonia in swine herds. Journal of the American Veterinary Medical Association, (1989) 195, 1702-1706.
Thacker E & Minion C. Mycoplasmosis. In: ZIMMERMAN, J.J. et al. (eds.). 2012. Diseases of Swine, 10th ed. Ames, Iowa: Wiley-Blackwell Publishing; 2012:779-797.